 |
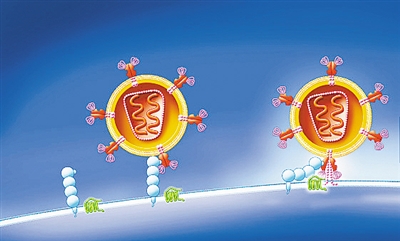
| 艾滋病病毒利用CD4蛋白感染免疫细胞。视觉中国 |
 |
实习生 何彩俪 本报记者 张 晔
多个国家正与之洽谈合作,多家医院争开第一张处方,新药刚上市即供不应求……一款国产新药竟也享受到了进口神药的待遇!
前沿生物药业(南京)股份有限公司近日宣布,其研发的全球首个长效HIV-1融合抑制剂——艾博韦泰(艾可宁)正式上市。这款研发周期长达十六年的创新药物,为何引起医学界高度关注?科学家明明知道艾滋病病毒(HIV)是如何攻击人体免疫系统,为何各类药物对它还是久攻不下?人类到何时才能真正降服艾滋病?
拥有“高智商”,让免疫军团沦陷
HIV可能是目前人类发现的最聪明的病毒。
人体内有一套强大的免疫系统,外界的细菌、病毒想要进入人体兴风作浪,都会受到免疫系统的迎头痛击。免疫系统由免疫器官、免疫细胞和免疫活性物质组成,仅免疫细胞就多达十余种,细菌、病毒想要战胜免疫系统绝非轻而易举的事。
但是,HIV却想了一个办法,不攻击人体组织,也不直接致人生病或死亡,而是攻击免疫细胞,致人体免疫系统失去抵抗力,从而导致各种疾病及癌症在人体内生存,最终发展为艾滋病(获得性免疫缺陷综合征)。
HIV十分微小,一个针尖上居然能容纳约16000个病毒颗粒。虽然身形小巧,但是它构造却很复杂,浑身布满几十上百个小铆钉般的GP120蛋白和GP41蛋白树突,看起来像个攻击力十足的“刺球”。
当HIV借助人的未保护性行为,或者通过受污染的注射器进行静脉注射等途径进入人体后,主要攻击的目标是辅助性T淋巴细胞。
T细胞很少给普通病毒攻城略地的机会,然而,每个HIV外的GP120上面都布满了糖分子,即便是专门负责识别外来信息的免疫细胞,看到包裹着糖分子的物质也会将其误认为人体正常细胞,使HIV逃避开免疫系统的清除。作为免疫细胞家族中的头号“杀手”,CD4+T细胞拥有可以结合识别抗原蛋白的大将CD4蛋白,HIV正是利用了CD4蛋白,将其膜表面的GP120与其结合作为病毒感染细胞的入港口。两个蛋白结合后,GP120就“原形毕露”了。
HIV利用“糖衣炮弹”阴谋得逞后,打开了进入T细胞的缺口。HIV的“主帅”——遗传物质(RNA)终于登场了。HIV中的RNA经过“逆转录”变为病毒DNA,并输入到免疫细胞的DNA中,使其变为HIV的“制造工厂”,从这里源源不断地向外输出新复制出来的HIV。
距离1981年第一次发现HIV已经37年了。截至2017年底,全球共有3670万人感染艾滋病。每年全球新增艾滋病感染者100万—200万,仅在中国每年新增感染者就有13.4万,防治形势十分严峻。
“鸡尾酒疗法”,最大限度减少耐药性
三十多年来,人类在与HIV的攻防战中,从恐慌到镇定,从束手无策到逐渐占据上风,完全归功于一代又一代各类抗艾新药。
“目前,全球已上市的抗艾滋病药物共32个,分为六大类,包括核苷类逆转录酶抑制剂、非核苷类逆转录酶抑制剂、蛋白酶抑制剂、融合抑制剂、辅助受体拮抗剂和整合酶抑制剂等。”前沿生物董事长、首席科学家谢东博士告诉科技日报记者。
上世纪90年代,在历经十几年的研究后,科学家发现了抗逆转录病毒疗法,从那时候起,艾滋病的确诊就从死亡宣判转变为了药物可控慢性病。艾滋病死亡人数大幅下降。
抗逆转录病毒疗法俗称“鸡尾酒疗法”,它通过三种或三种以上的抗病毒药物联合使用来治疗艾滋病,联用几种不同作用机制的药物可以减少病毒的“漏网率”,能够最大限度地减少单一用药的耐药性。
“鸡尾酒疗法”虽然能够清除人体循环系统中的病毒,但对生产新病毒的被感染免疫细胞束手无策。同时,由于其RNA逆转录为DNA的时候缺乏“纠错”的机制,极易“变异”,所以HIV会产生耐药性。
而被人类寄予厚望的疫苗,大多数以失败告终。究其原因,一是HIV攻击了人体免疫系统,保护性免疫反应难以达到全效;二是无法清除被感染细胞;三是HIV极易变异,防不胜防。
“近两年抗体药不断取得突破,比如3BNC117和VRC01抗体的发现,在科学界引起了广泛关注。”谢东说,科学家发现在纽约有位感染5年的拉丁裔艾滋病患者,他体内的病毒被自身的免疫系统很好地控制住了。科学家将他体内B细胞中产生抗体的基因进行了克隆,并在其中发现了以3BNC117为主的几个强效抗体。
实验证明,3BNC117不仅能够像普通艾滋病药物一样,阻断病毒的感染过程,它还能引起新的免疫应答,使人体产生更多抗体来应对病毒和被感染的细胞,使患者接受治疗后体内的病毒不会在短时间反弹。
作为目前国际上疗效最好、临床进展最快的广谱中和HIV抗体之一,3BNC117有望颠覆以往单纯靠抗病毒药物治疗艾滋病的传统疗法,有望让人类在与HIV的抗争中再拔一城。
抗艾小目标有望实现,数月内不用药
今年5月,由谢东、王昌进、陆荣健等海归博士组成的团队经过16年艰苦研发的艾可宁,正式获得上市批文,抗艾新药终于与患者见面。这是中国原创的一类长效抗艾新药,也是目前国际上活性最强的广谱抗艾滋病新药之一。
谢东介绍说,艾可宁是一种人类免疫缺陷病毒(HIV-1)融合抑制剂,以GP41为靶点,“它像门栓一样,牢牢锁住HIV表面膜蛋白与T细胞间的通道,抑制HIV在人体内的复制和传播。”
目前,全球有2000万感染者接受药物治疗,有耐药基因突变的大约有300万人,这是全球防治艾滋病的重大隐患。
“在医疗水平发达的地区,累积会有10%-15%的艾滋病患者出现耐药,而在医疗水平欠发达地区比如非洲,可能高达50%。”谢东介绍说,从药物靶点上看,艾可宁针对的是HIV某蛋白的一个全新区域,机理上可有效抑制绝大多数HIV,包括耐药病毒。
一周只需打针一次!对于每天都需要定时服药的患者而言,艾可宁不仅保护了隐私,还使得医从性大大降低。它是如何实现长效的呢?人体血液白蛋白的半衰期是2—3周,新药与白蛋白结合,可以把药物半衰期从两小时延长到12天。
除此以外,安全性高、副作用小也有别于传统抗艾药物。艾可宁是多肽类药物,分子量4666,是其他口服药的10倍。多肽在人体内将会代谢为氨基酸,不会攻击人体细胞,安全性高。
艾滋病一直是国际上重大公共卫生领域的难题,国际社会付出了巨大的努力,可是至今仍然无法研究出预防和根治艾滋病的有效药物。
“人类最终会战胜HIV,在短期内我希望实现一个小目标,就是‘无药控制’。”谢东透露,去年前沿生物与美国洛克菲勒大学完成授权许可交易,获得广谱中和HIV抗体3BNC117的全球许可,即将展开临床试验,将来有望与艾可宁双璧合一,联合用于HIV感染和艾滋病的治疗及预防,“将有可能让患者两周或一个月用一次药,连续用药一定时间后在体内产生抗体,从而在接下来的数月内不再用药,达到无药控制的小目标”。








