
 |
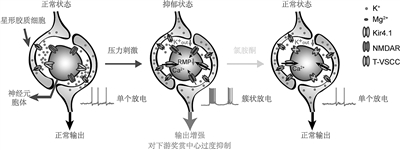
抑郁症严重损害了患者的身心健康,是现代社会自杀问题的重要诱因,给社会和家庭带来巨大的损失。然而传统抗抑郁药物起效缓慢(6—8周以上),并且只在20%左右的病人中起效。这提示目前对抑郁症机制的了解还没有触及其核心。近年来在临床上意外发现麻醉剂氯胺酮在低剂量下具有快速(1小时内)、高效(在70%难治型病人中起效)的抗抑郁作用,被认为是精神疾病领域近半个世纪最重要的发现。然而,氯胺酮具有成瘾性,副作用大,无法长期使用。因此,理解氯胺酮快速抗抑郁的机制已成为抑郁症研究领域的“圣杯”,因为它将提示抑郁症的核心脑机制,并为研发快速、高效、无毒的抗抑郁药物提供科学依据。2018年,浙江大学医学院胡海岚研究组在这一领域的研究取得了突破性的进展:在抑郁症的神经环路研究中,该研究组发现大脑中反奖赏中心——外侧缰核中的神经元活动是抑郁情绪的来源。这一区域的神经元细胞通过其特殊的高频密集的“簇状放电”, 抑制大脑中产生愉悦感的“奖赏中心”的活动。通过光遗传的技术手段,他们直接证明缰核区的簇状放电是诱发动物产生绝望和快感缺失等行为表现的充分条件。针对抑郁的分子机制,该研究组发现这种簇状放电方式是由NMDAR型谷氨酸受体介导的,作为NMDAR的阻断剂,氯胺酮的药理作用机制正是通过抑制缰核神经元的簇状放电,高速高效地解除其对下游“奖赏中心”的抑制,从而达到在极短时间内改善情绪的功效。同时,该研究组对产生簇状放电的细胞及分子机制做出了更深入的阐释。通过高通量的定量蛋白质谱技术,他们发现抑郁的形成伴随着胶质细胞中钾离子通道Kir4.1的过量表达。而Kir4.1通道对抑郁的调控植根于缰核组织中胶质细胞对神经元的致密包绕这一组织学基础。在神经元-胶质细胞相互作用的狭小界面中,Kir4.1在胶质细胞上的过表达引发神经元细胞外的钾离子浓度降低,从而诱发神经元细胞的超极化、T-VSCC钙通道活化,最终导致NMDAR介导的簇状放电。上述研究对于抑郁症这一重大疾病的机制做出了系统性的阐释,颠覆了以往抑郁症核心机制上流行的“单胺假说”,并为研发氯胺酮的替代品、避免其成瘾等副作用提供了新的科学依据。同时,该研究所鉴定出的NMDAR、Kir4.1钾通道、T-VSCC钙通道等可作为快速抗抑郁的分子靶点,为研发更多、更好的抗抑郁药物或干预技术提供了崭新的思路,对最终战胜抑郁症具有重大意义。


 下一版
下一版




