
5.揭示RNA剪接的关键分子机制
 |
| 施一公研究组已解析的剪接体结构 |
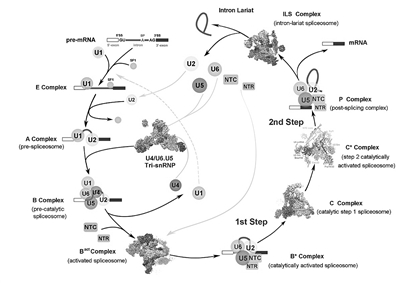
RNA剪接是地球上所有真核生物从DNA到蛋白质信息传递这一“中心法则”的关键一环。通过剪接反应,前体信使RNA中的内含子被剔除、外显子连接起来形成成熟的信使RNA,进一步才能被翻译成蛋白质。人类已知的遗传疾病中大约35%是由RNA剪接的异常导致的。RNA剪接的化学本质是前体信使RNA经历两步转酯反应完成剪和接两个关键步骤,每一步都需要由一个巨大的动态分子机器——剪接体来催化完成。因此,获取分子量达两百万道尔顿以上的剪接体在组装、激活、催化反应过程中各个状态的高分辨率空间三维结构是理解RNA剪接分子机制的必经之路,也是结构生物学界最富挑战性的课题。过去30年,这一生命科学基础研究的核心领域进展缓慢。清华大学生命科学学院施一公实验室针对这一重大科学难题,创新性地利用酵母内源性蛋白提取获得了性质良好的样品,并利用单颗粒冷冻电子显微镜技术,继2015年率先报道裂殖酵母剪接体的结构之后,在2016年取得重大突破,相继解析了3个关键工作状态下剪接体的近原子分辨率结构(即3.5埃的激活状态剪接体Bact complex、3.4埃的第一步催化反应后复合物C complex以及4.0埃的第二步催化激活状态下的C* complex)以及一个剪接体组装过程中重要复合物的高分辨率结构(即3.8埃的预组装复合物U4/U6.U5 tri-snRNP)。这4项进展均以长文的形式先后发表在2016年的《科学》周刊上(Science 351:466-475; 353:895-904;353:904-911; aak9979)。这4个高分辨率结构所代表的剪接体状态,基本覆盖了RNA剪接的关键催化步骤,从分子层面解释了剪接体执行RNA剪接的机制,极大地推动了RNA剪接这一基础研究领域的发展。







